植物の光合成やDNA修復酵素などにおいて、タンパク質は光を利用して電子伝達を行う中間体を効率よく生成し、 エネルギー変換へとつなぐ重要な働きをしています。 たとえば、DNA修復酵素において、タンパク質には基質がバインドされています。そこに光が当たると中間体として 電荷分離状態のものが生成されます。電荷分離状態によってできたタンパク質上のホール(正孔)が移動することにより エネルギー変換がおこなわれます。しかし、この電荷分離状態は非常に不安定であり、すぐにもとの安定な状態にもどってしまいます。そこで、生命ではもとの安定な状態に戻らないように中間体の向きや位置をうまく制御していると考えられています。 そのため、中間体の立体配置を調べることが重要であります。立体配置を解明することにより、タンパク質のエネルギー変換機構 の解明が進み、さらにはタンパク質を用いた人工光合成などの開発につながると期待されています。
成果
薬物を分子認識した超分子型タンパク質であるヒト血清アルブミン-アントラキノンスルフォン酸イオン複合体において、長寿命な近距離および長距離光電荷分離状態を人工的に効率よく生成させることに世界で初めて成功した。近接している中間体分子対においては、直交した立体配置が電子雲の重なりを大きく抑制し、もとの安定な分子に戻らないようにすることによって効率よく光エネルギー変換を起こす様子が明瞭に捉えられた(図1)。さらに、タンパク質表面領域の水和分子を介した軌道の重なりが長距離電子移動過程に重要な役割を果たすことも示された。(J. Am. Chem. Soc., 133, 16770-16773 (2011).)
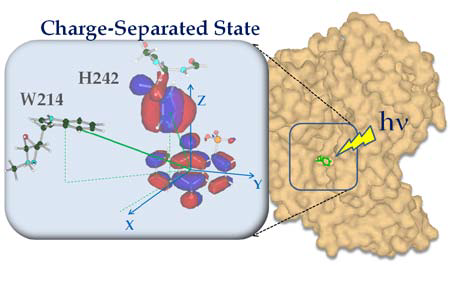
図1. 人工的な光エネルギー変換を起こすヒトタンパク質-薬物複合体における短寿命中間体の立体配置
薬物を分子認識した超分子型タンパク質においては、時間分解電子スピン共鳴法により、薬物−アミノ酸残基における立体構造を決定することができた(図1)。このことから本手法を用いてタンパク質−薬物相互作用の詳細を調べることができることが示されたといえる。疾患原因のタンパク質をターゲットとした薬物開発にとっても重要な成果である。さらに、タンパク質における光電荷分離過程は、タンパク質複合体用いた新しい光エネルギー変換として注目されており、可視光励起で効率よくエネルギー変換を起こす薬物など分子探索を行う予定である。
現在と今後の展開
薬物を分子認識した超分子型タンパク質においては、時間分解電子スピン共鳴法により、薬物−アミノ酸残基における立体構造を決定することができた(図1)。このことから本手法を用いてタンパク質−薬物相互作用の詳細を調べることができることが示されたといえる。疾患原因のタンパク質をターゲットとした薬物開発にとっても重要な成果である。さらに、タンパク質における光電荷分離過程は、タンパク質複合体用いた新しい光エネルギー変換として注目されており、可視光励起で効率よくエネルギー変換を起こす薬物など分子探索を行う予定である。